Übersetzen Sie diese Seite in:
Englisch
Originalartikel
90 (
5
); 581-589
doi:
10.25259/IJDVL_854_2022
pmid:
37609732
, Khaled El Mulla, Abeer Alshaer, Heba M. Ashraf 1 , Eman A. Omran 1
Abteilung für Dermatologie, Medizinische Fakultät Alexandria, ElAzarita, Alexandria, Ägypten
1Abteilung für Mikrobiologie, High Institute of Public Health, Alexandria University, ElAzarita, Alexandria, Ägypten
Korrespondierende Autorin: Dr. Marwa Elsaeed Eldeeb, Abteilung für Dermatologie, Medizinische Fakultät Alexandria, Elazarita, Alexandria, Ägypten. marwa.eldeeb16@alexmed.edu.eg
- Empfangen: 26.09.2022, Akzeptiert: 08.03.2023, Epub vor Drucklegung: 21.07.2023, Veröffentlicht: 08.08.2024
© 2024 Indian Journal of Dermatology, Venereology and Leprology - Veröffentlicht von Scientific Scholar
So zitieren Sie diesen Artikel: Eldeeb ME, El Mulla K,Alshaer A, Ashraf HM, Omran EA. Die Wirkung der langgepulsten 1064 nm Nd:YAG-Laser-unterstützten Haarentfernung auf einige Hautflora und Krankheitserreger: Eine In-vivo- Studie. Indian J Dermatol Venereol Leprol. 2024;90:581-9. doi: 10.25259/IJDVL_854_2022
Abstrakt
Hintergrund
Die Wirkung von NDYag auf die normale Hautflora und pathogene Mikroben wurde nicht untersucht.
Ziele
Bewertung der sofortigen (vor im Vergleich nach jeder Sitzung) und verzögerten (vor der ersten Sitzung im Vergleich vor der vierten Sitzung) antimikrobiellen Wirkung der Nd:YAG-Laser-unterstützten Haarentfernung.
Methoden
Dreißig Frauen, bei denen eine Achselhaarentfernung mit einem Nd:YAG-Laser geplant war, wurden eingeschlossen. Vor und nach jeder der vier Sitzungen wurden Hautabstriche aus dem Gewölbe der dominanten Achsel entnommen. Bakteriologische Kulturen wurden angelegt, um die Gesamtzahl der Aerobier, Anaerobier, lipophilen Bakterien, Staphylokokken, Staphylococcus epidermidis ( S. epidermidis ), S. saprophyticus , S. hominis und S. aureus zu erfassen. Gemeldete Veränderungen des Schweißgeruchs und der Follikulitis (sofern vorhanden) wurden aufgezeichnet.
Ergebnisse
S. hominis war bei allen Probanden vor und nach allen Sitzungen die vorherrschende Art. Die Gesamtzahl der Aerobier, Anaerobier, lipophilen Bakterien, Staphylokokken und S. hominis nahm nach allen 4 Sitzungen signifikant ab. Vor der vierten Sitzung wurde eine signifikante Verringerung der mittleren Koloniezahlen im Vergleich zur Basiszahl vor der ersten Sitzung bei den Gesamtaerobiern (278,9 gegenüber 126,3 × 10 5 KBE/cm 2 , p = 0,003), den Gesamtanaerobiern (338,7 gegenüber 103,7 × 10 5 KBE/cm 2 , p = 0,002) und den Gesamtstaphylokokken (248,5 gegenüber 105,0 × 10 5 KBE/cm 2 , p = 0,004) festgestellt. Die meisten Probanden berichteten von einer Verschlechterung oder einem unveränderten Achselschweißgeruch. Es bestand eine statistisch signifikante positive Korrelation zwischen Schweißgeruch und der Gesamtzahl der Aerobier ( r = 0,433, p = 0,017), der Gesamtzahl der Anaerobier ( r = 0,377, p = 0,040), der Gesamtzahl der Staphylokokken ( r = 0,383, p = 0,036) und S. hominis ( r = 0,497, p = 0,005); niedrigere Zahlen waren mit einer Verschlechterung des Geruchs verbunden.
Einschränkungen
Kleine Stichprobengröße, wenige Lasersitzungen, kurze Nachbeobachtung, subjektive Beurteilung von Schweißgeruch und -menge.
Schlussfolgerungen
Der Laser bewirkte eine sofortige und verzögerte Reduktion von aeroben, anaeroben, lipophilen Bakterien und Staphylokokken in der Achselhöhle. Diese Form der Dysbiose kann zu Veränderungen des Schweißgeruchs führen.
Schlagwörter
Nd:YAG-Laser
Hautflora
Staphylokokken
Follikulitis
Gesamtaerobe Zahl
Verwandte Artikel von PubMed anzeigen
Einführung
Die Haarentfernung mit dem Laser ist zur bevorzugten Behandlungsmethode zur Entfernung unerwünschter Haare geworden. 1 Die am häufigsten für diesen Zweck verwendeten Laser sind Diodenlaser (800 nm), Alexandritlaser (795 nm) und Neodym-Yttrium-Aluminium-Granat-Laser (Nd:YAG) (1064 nm). 2
Die Absorption durch Melanin bei 1064 nm ist geringer als bei kürzeren Wellenlängen, reicht aber immer noch aus, um eine selektive Photothermolyse des pigmentierten Haarfollikels mit dauerhafter Zerstörung zu ermöglichen. 3,4 Dadurch wird der thermische Schaden an der umgebenden Epidermis reduziert, was den Nd:YAG-Laser zur sichersten Option bei Patienten mit dunkler Haut macht. 5
Ein charakteristischer Achselgeruch entsteht, wenn eine große und dauerhafte Population von Mikroorganismen von Sekreten aus ekkrinen, apokrinen und Talgdrüsen lebt. Die ansässige Achselmikrobiota besteht hauptsächlich aus Bakterien der Gattungen Staphylococcus, Micrococcus, Corynebacterium und Propionibacterium. Bei Frauen überwiegen Staphylokokken gegenüber Corynebakterien. 6 Die Verwendung eines Lasers zur Haarentfernung kann die mikrobielle Flora verändern, was mit einer Veränderung des Schweißgeruchs einhergehen kann. Die Dauer dieser antimikrobiellen Wirkung ist unbestimmt, ebenso wie die damit einhergehenden Hautveränderungen wie Schweißgeruch und -menge. 7
Studien über die Wirkung des Nd:YAG-Lasers auf die Hautflora sind rar. Ziel der vorliegenden Studie war es, die Wirkung der Haarentfernung mit dem Nd:YAG-Laser auf die Dichte einiger Hautflora und Krankheitserreger in der Achselhöhle (sowohl sofortige als auch verzögerte Wirkungen) sowie die Beziehung zwischen Veränderungen der Bakterienzahl und Veränderungen des Geruchs und der Menge des Achselschweißes zu untersuchen.
Themen und Methoden
Diese quasi-experimentelle unterbrochene Zeitreihenstudie (ClinicalTrials.gov ID NCT05034237) wurde über 10 Monate von Januar bis November 2021 an 30 Frauen durchgeführt, die in der dermatologischen Ambulanz des Alexandria Main University Hospital, Ägypten, rekrutiert wurden. Die Genehmigung des Medizinischen Ethikkomitees der Medizinischen Fakultät von Alexandria wurde eingeholt (IRB Nr. 00012098). Von jeder Teilnehmerin wurde eine informierte schriftliche Einverständniserklärung eingeholt.
Ausgewählt wurden Teilnehmer im Alter von 20–40 Jahren, die Hauttyp III–V nach Fitzpatrick hatten und noch keine vorherige Haarentfernung per Laser in den Achselhöhlen hatten. Teilnehmer mit entzündlichen Hauterkrankungen wie Neurodermitis oder Psoriasis oder Pilz- oder Herpesinfektionen wurden ausgeschlossen, ebenso wie Diabetiker, Personen unter immunsupprimierender Therapie sowie schwangere oder stillende Frauen. Ein vorgefertigtes Datenblatt wurde verwendet, um Patientendaten wie Alter, Anzahl der Lasersitzungen, Hauttyp, Follikulitis-Vorgeschichte sowie Laborergebnisse zu erfassen. Ergebnisse hinsichtlich Veränderungen von Schweißgeruch und -menge wurden in der letzten Sitzung im Vergleich zur ersten Sitzung ebenfalls aufgezeichnet.
Lasersitzungen
Alle Teilnehmerinnen unterzogen sich vier Sitzungen zur lasergestützten Haarentfernung im Abstand von 4 Wochen mit einem langgepulsten 1064 nm Nd:YAG-Laser (Cynosure Elite+™, Westford, USA). Die Parameter wurden entsprechend Haarfarbe, -dicke und -dichte und Hautfototyp festgelegt (15–18 mm Punktgröße, Fluenz 24–35 J/cm 2 , Pulsdauer 30–40 ms). Alle Teilnehmerinnen wurden angewiesen, 72 Stunden vor der Probenentnahme keine oralen oder topischen Antibiotika einzunehmen, die Achselhöhle 24 Stunden vor der Sitzung nicht mit Seife zu waschen, während der gesamten Studie keine Deodorants, antimykotischen oder antibakteriellen Reinigungsprodukte in der Achselhöhle zu verwenden und vor den Sitzungen kein topisches Anästhetikum anzuwenden.
Probenentnahme
Unmittelbar vor und nach der Sitzung wurden Abstriche genommen, da jeder Zeitverzug die Bakterienzahl beeinflusst hätte (Bakterien vermehren sich mit der Zeit). Jedes Mal (vor oder nach der Laserbehandlung) wurden zwei sterile Tupfer gleichzeitig für die Entnahme von Hautabstrichen verwendet; diese wurden dann in 2 ml sterile Thioglykolat-Brühe (eine Anreicherungsbrühe, die das Wachstum von Anaerobiern, Aerobiern und mikroaerophilen Mikroorganismen fördert) gegeben. Es wurde eine modifizierte standardisierte Abstrichmethode verwendet, die von Selwyn und Ellis (1972) beschrieben wurde. 8 Die mit steriler Kochsalzlösung angefeuchteten Tupfer wurden 30 Sekunden lang mit mäßigem Druck auf einer 2 × 2 cm 2 großen Fläche der rechten Achselhöhle kräftig gerieben. Das Röhrchen, in das die beiden Tupfer gegeben wurden, wurde beschriftet, in eine Kühlbox gelegt und innerhalb von 2 Stunden zur sofortigen Verarbeitung in das mikrobiologische Labor des High Institute of Public Health der Universität Alexandria transportiert.
Labormethoden
Das Röhrchen mit den beiden Tupfern und der Thioglykolatbrühe wurde 30 Sekunden lang verwirbelt, um alle an den Tupfern haftenden Bakterien zu lösen und die Bakterien gleichmäßig in der flüssigen Brühe zu verteilen. Ein Volumen von 1 ml der Brühe wurde in jedes der sechs Verdünnungsröhrchen überführt, um Verdünnungen von 10 −1 bis 10 −6 zu erhalten. Diese Verdünnungen wurden verwendet, um die erforderlichen Platten zu kultivieren. Eine automatische Pipette entnahm ein Volumen von 100 µl aus jedem Verdünnungsröhrchen, um jede der folgenden Platten zu kultivieren: zwei Blutagarplatten (für die Gesamtbakterienzahl, eine für aerobe und eine für anaerobe Inkubation), eine Mannitol-Kochsalz-Agarplatte (zur Zählung aller Staphylokokken und zum Nachweis von S. aureus ), mit 0,5 % Tween 80 ergänzter Blutagar (zur Zählung lipophiler Bakterien) und chromogene Staphylococcus-Agarplatten (Condalab, Madrid, Spanien, Kat.-Nr. 2076) zur Identifizierung und Zählung der Staphylokokkenarten. Alle Platten wurden 24 bis 48 Stunden lang aerob bei 37°C inkubiert, mit Ausnahme der Blutagarplatte zur Zählung der Anaerobier, die 5 Tage lang mit Gaspackungen bei 37°C inkubiert wurde.
Verfahren zur Zählung und Identifizierung von Bakterienkolonien
Zur Zählung wurden Platten aus Verdünnungen ausgewählt, die die besten zählbaren Kolonien zeigten (30–300 koloniebildende Einheiten (CFU)/Platte). Die Identifizierung von S. aureus auf Mannitol-Salz-Agar erfolgte gemäß standardmäßiger mikrobiologischer Methoden. 8 Isolate, die auf chromogenem (CHROM) Agar wuchsen, wurden gemäß den Anweisungen des Herstellers anhand ihrer Farbe identifiziert, 9 und die Identität der Isolate wurde mithilfe biochemischer Tests bestätigt. S. aureus wurde auf Cefoxitin-Empfindlichkeit getestet, um Methicillin-resistenten S. aureus (MRSA) zu identifizieren. 8 S. hominis wurden identifiziert, indem sie Koagulase-negativ waren, gefolgt von einer automatischen Identifizierung durch Vitek 2 Compact (bioMérieux, Frankreich).
Die endgültige Koloniezahl wurde im Verhältnis zur abgestrichenen Oberfläche und der verwendeten Verdünnung berechnet und in koloniebildenden Einheiten (CFU)/ cm² ausgedrückt. Bei Bedarf wurde eine automatische Bakterienidentifizierung mit Vitek 2 Compact (bioMérieux, Frankreich) durchgeführt, um Isolate zu bestätigen.
Beurteilung von Schweißgeruch und -menge sowie Vorhandensein oder Fehlen einer Follikulitis
Die Teilnehmer wurden bis zum Ende der Studie (vierte Lasersitzung) nach Veränderungen der Schweißmenge und des Geruchs gefragt. Veränderungen der Schweißmenge wurden als verringert, erhöht oder unverändert klassifiziert, während Veränderungen des Geruchs als Punktzahl ausgedrückt wurden: verbessert (+1), verschlechtert (–1) oder unverändert (0). Jede Vorgeschichte wiederkehrender Achselfollikulitis wurde bis zum Ende der Studie erneut bewertet.
Statistische Analyse
Die Daten wurden in den Computer eingespeist und mit dem Softwarepaket IBM SPSS, Version 25.0, analysiert . Qualitative Daten wurden mithilfe von Zahlen und Prozentsätzen beschrieben. Der Kolmogorov-Smirnov-Test wurde verwendet, um die Normalverteilung zu überprüfen; die Daten waren nicht normal verteilt. Quantitative Daten wurden mithilfe von Bereich (Minimum und Maximum), Mittelwert, Standardabweichung und Median beschrieben. Die Signifikanz wurde auf dem 5%-Niveau beurteilt. Die verwendeten Tests waren: der Wilcoxon-Vorzeichen-Rang-Test als nichtparametrischer Test für quantitative Variablen zum Vergleich zwischen zwei verwandten Gruppen (Paarvergleich), Friedman-Test als nichtparametrischer Test für quantitative Variablen zum Vergleich zwischen mehr als zwei verwandten Gruppen (Paarvergleich), Spearmans Rho-Korrelation (für abnormal verteilte quantitative Variablen) und der Mann-Whitney-Test für quantitative Variablen zum Vergleich zwischen zwei unabhängigen Gruppen.
Ergebnisse
Das Durchschnittsalter unserer Teilnehmerinnen betrug 26 Jahre, mit Hautphototypen III-V. Fünf Personen gaben an, an wiederkehrender Follikulitis zu leiden.
Die sofortige antimikrobielle Wirkung des Nd:YAG-Lasers
Dies wurde durch Vergleich der Bakterienzahlen vor und nach jeder Lasersitzung ausgewertet. Bereits bei der ersten Sitzung kam es zu signifikanten Reduktionen ( p < 0,001) der koloniebildenden Einheiten (KBE/ cm² ) der gesamten Aerobier (278,9 gegenüber 111,3 × 105 ), der gesamten Anaerobier (338,7 gegenüber 66,3 × 105 ), der lipophilen Bakterien (205,0 gegenüber 78,7 × 105 ), der gesamten Staphylokokken (248,5 gegenüber 85,0 × 105 ) und von S. hominis (120,0 gegenüber 25,0 × 105 ) [Tabelle 1] [Abbildung 1]. Dieses Reduktionsmuster war auch bei der zweiten, dritten und vierten Lasersitzung zu beobachten.
| Bakterienart | Koloniezahl (×10 5 KBE/cm 2 ) | p-Wert | |
|---|---|---|---|
| Vor der ersten Sitzung | Nach der ersten Sitzung | ||
| Aerobier insgesamt | |||
| Mittelwert ± SD | 778,3 ± 1429,7 | 511,4 ± 1318,7 | Wilcoxon-Vorzeichen-Rang-Test = 30,0 P < 0,001* |
| Mittlere | 278,9 | 111.3 | |
| Min-Max | 2,5 bis 6250,0 | 0,0–6012,0 | |
| Gesamtanzahl Anaerobier | |||
| Mittelwert ± SD | 787,3 ± 1422,9 | 305,1 ± 693,4 |
Wilcoxon-Vorzeichen-Rang-Test = 30,0 P < 0,001* |
| Mittlere | 338,7 | 66,3 | |
| Min-Max | 2,5–6662,5 | 0,0–3737,0 | |
| Staphylokokken insgesamt | |||
| Mittelwert ± SD | 408,6 ± 536,1 | 455,9 ± 1703,6 |
Wilcoxon-Vorzeichen-Rang-Test = 37,0 P < 0,001* |
| Mittlere | 248,5 | 85,0 | |
| Min-Max | 12,5–2720,0 | 0,0–9425,0 | |
| Lipophile Bakterien | |||
| Mittelwert ± SD | 936,5 ± 2268,7 | 244,7 ± 646,2 |
Wilcoxon-Vorzeichen-Rang-Test = 19,0 P < 0,001* |
| Mittlere | 205,0 | 78,7 | |
| Min-Max | 0,0–9262,0 | 0,0–3532,5 | |
| S. epidermidis | |||
| Mittelwert ± SD | 1,4 ± 7,3 | 4,8 ± 22,0 |
Wilcoxon-Vorzeichen-Rang-Test = 4,0 P = 0,593 |
| Mittlere | 0,0 | 0,0 | |
| Min-Max | 0,0–40,0 | 0,0–120,0 | |
| S. saprophyticus | |||
| Mittelwert ± SD | 9,4 ± 27,6 | 11,4 ± 53,3 | Wilcoxon-Vorzeichen-Rang-Test = 8,0 P = 0,161 |
| Mittlere | 0,0 | 0,0 | |
| Min-Max | 0,0–125,0 | 0,0–292,0 | |
| S. hominis | |||
| Mittelwert ± SD | 246,3 ± 300,6 | 108,4 ± 157,6 |
Wilcoxon-Vorzeichen-Rang-Test = 25,0 P < 0,001* |
| Mittlere | 120,0 | 25,0 | |
| Min-Max | 3,4–1283,7 | 0,0–578,5 | |
P*: p-Wert signifikant auf Niveau < 0,05
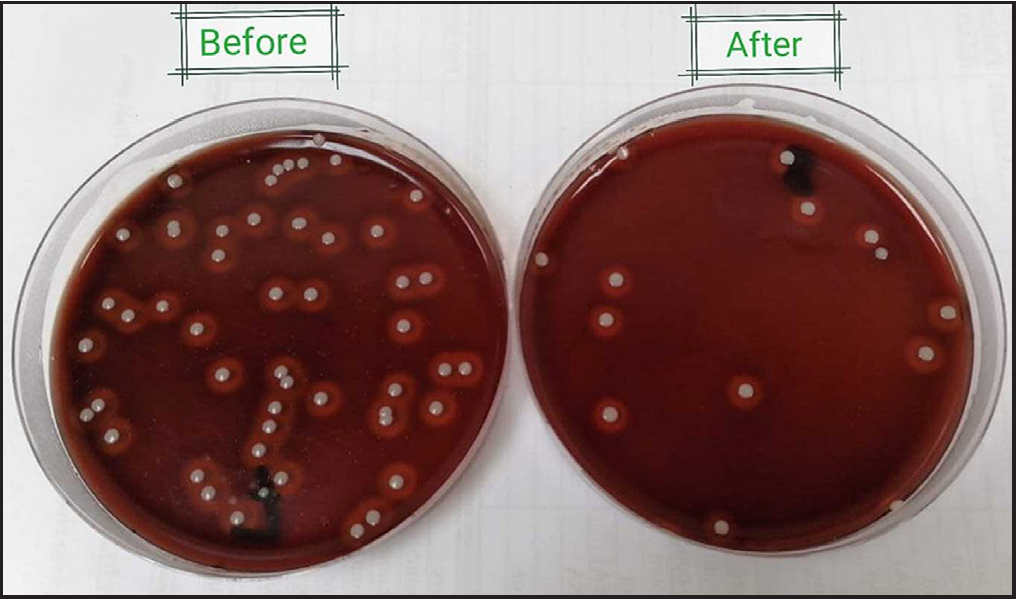

- Blutagarplatten zeigen die Gesamtzahl lipophiler Bakterien vor (links) und nach (rechts) der dritten Sitzung eines Teilnehmers.
Die verzögerte antimikrobielle Wirkung des Nd:YAG-Lasers
Dies wurde durch Vergleich der Bakterienzahlen vor der ersten und vierten Lasersitzung ausgewertet. Es gab eine signifikante Verringerung der mittleren Koloniezahlen (KBE/ cm² ) für Aerobier insgesamt (278,9 gegenüber 126,3 × 105 , p = 0,003), Anaerobier insgesamt (338,7 gegenüber 103,7 × 105 , p = 0,002) und Staphylokokken insgesamt (248,5 gegenüber 105,0 × 105 , p = 0,004). Es wurden auch Verringerungen der mittleren Anzahl lipophiler Bakterien und S. hominis beobachtet, diese erreichten jedoch keine statistische Signifikanz [Tabelle 2].
| Bakterienart | Koloniezahl (×10 5 KBE/cm 2 ) | p-Wert | |
|---|---|---|---|
| Vor der ersten Sitzung | Vor der vierten Sitzung | ||
| Aerobier insgesamt | |||
| Mittelwert ± SD | 778,3 ± 1429,7 | 172,6 ± 176,6 |
Wilcoxon-Vorzeichen-Rang-Test = 89,0 p = 0,003* |
| Mittlere | 278,9 | 126,3 | |
| Min-Max | 2,5 bis 6250,0 | 1,0 bis 762,5 | |
| Gesamtanzahl Anaerobier | |||
| Mittelwert ± SD | 787,3 ± 1422,9 | 400,6 ± 1069,7 | Wilcoxon-Vorzeichen-Rang-Test = 84,0 p = 0,002* |
| Mittlere | 338,7 | 103,7 | |
| Min-Max | 2,5–6662,5 | 2,5–5037,5 | |
| Staphylokokken insgesamt | |||
| Mittelwert ± SD | 408,6 ± 536,1 | 510,1 ± 1659,0 |
Wilcoxon-Vorzeichen-Rang-Test = 91,0 p = 0,004* |
| Mittlere | 248,5 | 105,0 | |
| Min-Max | 12,5–2720,0 | 1,5–8612,5 | |
| Lipophile Bakterien | |||
| Mittelwert ± SD | 936,5 ± 2268,7 | 189,3 ± 295,5 |
Wilcoxon-Vorzeichen-Rang-Test = 144,5 p = 0,070 |
| Mittlere | 205,0 | 110,0 | |
| Min-Max | 0,0–9262,0 | 0,0–1250,0 | |
| S. epidermedis | |||
| Mittelwert ± SD | 1,4 ±7,3 | 4,0 ±21,9 |
Wilcoxon-Vorzeichen-Rang-Test = 3,0 p = 1,000 |
| Mittlere | 0,0 | 0,0 | |
| Min-Max | 0,0–40,0 | 0,0–120,0 | |
| S. saprophyticus | |||
| Mittelwert ± SD | 9,4 ± 27,6 | 18,3 ± 47,7 |
Wilcoxon-Vorzeichen-Rang-Test = 35,0 p = 0,445 |
| Mittlere | 0,0 | 0,0 | |
| Min-Max | 0,0–125,0 | 0,0–237,5 | |
| S. hominis | |||
| Mittelwert ± SD | 246,3 ± 300,6 | 145,8 ± 198,8 | Wilcoxon-Vorzeichen-Rang-Test = 150,0 p = 0,090 |
| Mittlere | 120,0 | 70,0 | |
| Min-Max | 3,4–1283,7 | 0,0–825,0 | |
P*: p-Wert signifikant auf Niveau <0,05*
Bei den Staphylokokkenarten machte S. hominis vor der ersten und vierten Sitzung 96,6 % bzw. 83,3 % der Arten aus. S. saprophyticus machte vor der ersten und vierten Sitzung 3,3 % bzw. 10 % aus, während die entsprechenden Werte für S. epidermidis 0 % bzw. 3,3 % betrugen (Daten nicht gezeigt). Bei vier Teilnehmerinnen wurde in den Achselabstrichen vorübergehend S. aureus nachgewiesen, bei drei Teilnehmerinnen vor der dritten Lasersitzung S. aureus (mit einer mittleren Koloniezahl von 10 × 105 KBE/ cm2 ) und bei einer Teilnehmerin wurde sowohl vor als auch nach der dritten Lasersitzung ein positiver S. aureus- Befund festgestellt (Kolonienzahlen von 307,5 × 105 bzw. 5 × 105 KBE/ cm2 ). Bei keinem der S. aureus- Isolate handelte es sich nach der Diagnose um MRSA, da sie alle empfindlich auf Cefoxitin reagierten.
Beim Vergleich der mittleren Bakterienzahlen vor jeder Sitzung ergab sich ein signifikanter Unterschied zwischen den vier Sitzungen hinsichtlich der Gesamtzahl der Aerobier (Post-hoc-Test, p = 0,010), der Gesamtzahl der Anaerobier (Post-hoc-Test, p = 0,008), der Gesamtzahl der Staphylokokken (Post-hoc-Test, p = 0,001) und S. hominis (Post-hoc-Test, p = 0,036). Beim Vergleich der mittleren Bakterienzahlen nach jeder Sitzung ergab sich ein signifikanter Unterschied zwischen den vier Sitzungen hinsichtlich der Gesamtzahl der Aerobier (Post-hoc-Test, p = 0,002), der Gesamtzahl der Anaerobier (Post-hoc-Test, p < 0,001), der Gesamtzahl der Staphylokokken (Post-hoc-Test, p = 0,031) und der lipophilen Bakterien (Post-hoc-Test, p = 0,022). [Abbildungen 2 und 3].
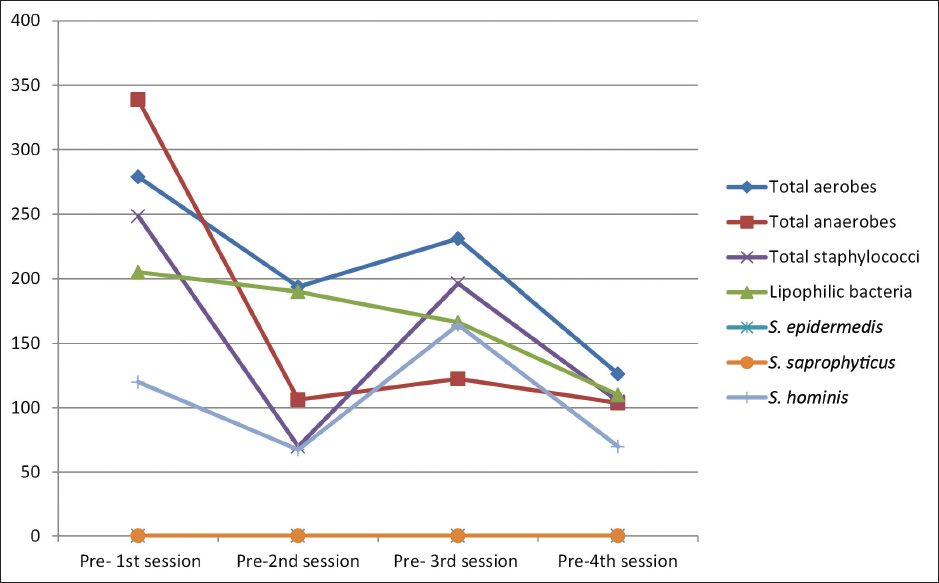

- Verteilung der untersuchten Teilnehmer (n = 30) nach der mittleren Bakterienkoloniezahl vor jeder Sitzung (S1, S2, S3 und S4).
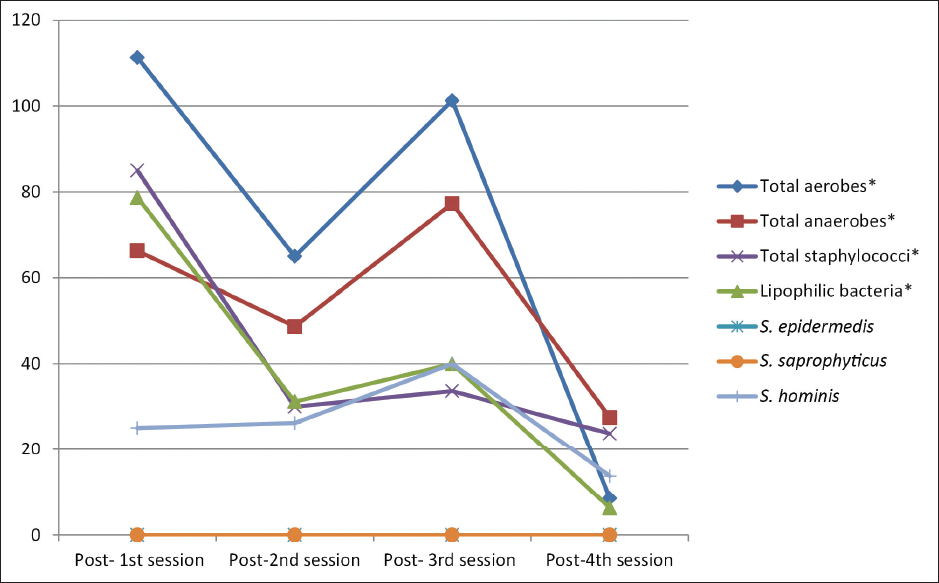

- Verteilung der untersuchten Teilnehmer (n = 30) nach der mittleren Bakterienkoloniezahl nach jeder Sitzung (S1, S2, S3 und S4).
Subjektive Veränderungen des Schweißgeruchs und der Schweißmenge
Am Ende der Studie berichteten zwölf Teilnehmerinnen (40 %) von einer Verschlechterung des Schweißgeruchs, zwei (6,7 %) von einer Verbesserung des Geruchs und sechzehn (53,3 %) von keiner Veränderung des Geruchs [Tabelle 3]. Die vorherrschende Art bei denjenigen mit Verschlechterung und Verbesserung des Schweißgeruchs war S. hominis . Eine Teilnehmerin, die in ihren Achselabstrichen vorübergehend S. aureus nachwies, berichtete von einer Verschlechterung des Achselgeruchs. Bezüglich der Schweißmenge berichteten sechzehn Frauen (53,3 %) von keiner Veränderung, zehn (33,3 %) von einer Zunahme und vier (13,4 %) von vermindertem Schwitzen.
| N | % | |
|---|---|---|
| Schweißgeruch | ||
| Verschlechtert | 12 | 40,0 |
| Verbessert | 2 | 6.7 |
| Unverändert | 16 | 53,3 |
| Schweißmenge | ||
| Verringert | 4 | 13.4 |
| Erhöht | 10 | 33.3 |
| Unverändert | 16 | 53,3 |
Die Bakterienzahlen zu Beginn der ersten Lasersitzung unterschieden sich bei Personen, die später eine Verschlechterung des Schweißgeruchs meldeten, nicht signifikant von denen bei Personen, die keine Veränderung des Geruchs meldeten (Daten nicht gezeigt). Die Zahlen vor der vierten Lasersitzung zeigten jedoch deutliche Unterschiede. Bei Personen mit Verschlechterung des Geruchs wurden statistisch signifikant niedrigere Zahlen für die Gesamtheit der Aerobier (52,5 gegenüber 142,5 × 105 KBE/ cm2 ) ( p = 0,029), die Gesamtheit der Anaerobier (23,7 gegenüber 128,7 × 105 KBE/ cm2 ) ( p = 0,047) und S. hominis (17,5 gegenüber 117,5 × 105 KBE/ cm2 ) ( p = 0,033) gefunden. Dies weist darauf hin, dass niedrigere Zahlen dieser Organismen mit der Wahrnehmung eines unangenehmen Schweißgeruchs verbunden waren [Tabelle 4]. Da nur zwei Teilnehmer eine Verbesserung ihres Schweißgeruchs berichteten, wurden sie von der statistischen Analyse, die Schweißgeruch und Bakterienzahlen korrelierte, ausgeschlossen [Tabelle 4]. Diese beiden Teilnehmer wiesen vor ihrer ersten bzw. vierten Lasersitzung folgende mittlere Bakterienzahlen (KBE/ cm² ) auf: Aerobier insgesamt (386,4 gegenüber 391,3), Anaerobier insgesamt (244,7 gegenüber 1718,7 × 105 ) und S. hominis (301,2 gegenüber 300 × 105 KBE/ cm² ).
| Bakterienart | Koloniezahl (×10 5 KBE/cm 2 ) | p-Wert | |
|---|---|---|---|
| Verschlechterter Schweißgeruch | Unveränderter Schweißgeruch | ||
| Aerobier insgesamt | |||
| Mittelwert ± SD | 102,5 ± 136,8 | 197,9 ± 158,3 |
p = 0,029* U = 142,5 |
| Mittlere | 52,5 | 142,5 | |
| Min-Max | 1,0 bis 485,0 | 7,5–647,5 | |
| Gesamtanzahl Anaerobier | |||
| Mittelwert ± SD | 97,4 ± 160,2 | 463,5 ± 1225,2 |
p = 0,047* U = 138,5 |
| Mittlere | 23,7 | 128,7 | |
| Min-Max | 52,0–572,5 | 2,5–5037,5 | |
| Staphylokokken insgesamt | |||
| Mittelwert ± SD | 72,1 ± 99,8 | 872,5 ± 2238,0 |
p = 0,082 U = 133,5 |
| Mittlere | 18,5 | 111.3 | |
| Min-Max | 1,5–310,0 | 2,5–8612,5 | |
| Lipophile Bakterien | |||
| Mittelwert ± SD | 103,2 ± 110,1 | 205,3 ± 306,3 |
p = 0,108,5 U = 1,980 |
| Mittlere | 56,2 | 153,7 | |
| Min-Max | 0,0–342,5 | 0,0–1250,0 | |
| S. saprophyticus | |||
| Mittelwert ± SD | 4,1 ± 11,5 | 24,2 ± 62,4 |
p = 0,837 U = 101,0 |
| Mittlere | 0,0 | 0,0 | |
| Min-Max | 0,0–37,5 | 0,0–237,5 | |
| S. hominis | |||
| Mittelwert ± SD | 53,6 ± 73,1 | 198,8 ± 242,2 |
p = 0,033* U = 148,0 |
| Mittlere | 17,5 | 117,5 | |
| Min-Max | 0,0 bis 242,5 | 2,5–825,0 | |
P*: p-Wert signifikant auf Niveau <0,05
Bei den zwölf Frauen, die von verstärktem Schweißgeruch berichteten, wurde zwischen der ersten und der vierten Sitzung eine signifikante Verringerung der folgenden mittleren Bakterienzahlen (KBE/ cm² ) festgestellt (Proben vor der Sitzung): Aerobier insgesamt (248,7 gegenüber 52,5 × 105 , p = 0,005), Anaerobier insgesamt (365 gegenüber 23,7 × 105 , p = 0,010), Staphylokokken insgesamt (232,5 gegenüber 18,5 × 105 , p = 0,008) und S. hominis (45 gegenüber 17,5 × 105 , p = 0,019). Außerdem wurde eine, wenn auch statistisch unbedeutende, Verringerung der mittleren Anzahl lipophiler Bakterien (307,5 gegenüber 56,2 × 105 ) beobachtet. Dagegen gab es bei allen sechzehn Frauen, die von unverändertem Schweißgeruch berichteten, keinen signifikanten Unterschied in der Bakterienzahl [Tabelle 5].
| Bakterienart | Koloniezahl (×10 5 KBE/cm 2 ) | |||||
|---|---|---|---|---|---|---|
| Unveränderter Schweißgeruch (n = 16) | Verschlechterter Schweißgeruch (n = 12) | |||||
| Vor S1 | Vor S4 | p-Wert | Vor S1 | Vor S4 | p-Wert | |
| Aerobier insgesamt | ||||||
| Mittelwert ± SD | 893,3 ± 1759,9 | 197,9 ± 158,3 |
=0,163 Wilcoxon =41,0 |
690,2 ± 1052,6 | 102,5 ± 136,8 |
= 0,005* Wilcoxon = 3,0 |
| Mittlere | 253,4 | 142,5 | 248,7 | 52,5 | ||
| Min-Max | 40,0–6250,0 | 7,5–647,5 | 2,5–3817,5 | 1,0–485,0 | ||
| Gesamtanzahl Anaerobier | ||||||
| Mittelwert ± SD | 343,0 ± 918,5 | 463,5 ± 1225,2 |
= 0,196 Wilcoxon = 43,0 |
1121,6 ± 297,9 | 97,4 ± 160,2 |
0,010* Wilcoxon = 6,0 |
| Mittlere | 311.2 | 128,7 | 365,0 | 23,7 | ||
| Min-Max | 3,9–1121,2 | 2,5–5037,5 | 2,5–6662,5 | 52,0–572,5 | ||
| Staphylokokken insgesamt | ||||||
| Mittelwert ± SD | 344,3 ± 368,0 | 872,5 ± 2238,0 |
= 0,214 Wilcoxon = 44,0 |
460,0 ± 746,1 | 72,1 ± 99,8 |
0,008* Wilcoxon = 5,0 |
| Mittlere | 228,5 | 111.3 | 232,5 | 18,5 | ||
| Min-Max | 12,5–1397,5 | 2,5–8612,5 | 25,0–2720,0 | 1,5–310,0 | ||
| Lipophile Bakterien | ||||||
| Mittelwert ± SD | 735,0 ± 2277,8 | 205,3 ± 306,3 |
= 0,266 Wilcoxon = 46,5 |
1314,1 ± 2606,1 | 103,2 ± 110,1 |
= 0,099 Wilcoxon = 15 |
| Mittlere | 142,5 | 153,7 | 307,5 | 56,2 | ||
| Min-Max | 2,5–9262,3 | 0,0–1250,0 | 0,0–8287,0 | 0,0–342,5 | ||
| S. saprophyticus | ||||||
| Mittelwert ± SD | 9,5 ± 22,7 | 24,2 ± 62,4 |
0,600 Wilcoxon = 13,0 |
0,42 ± 1,5 | 4,1 ± 11,5 |
= 0,317 Wilcoxon = 1,000 |
| Mittlere | 0,0 | 0,0 | 0,0 | 0,0 | ||
| Min-Max | 0,0–79,7 | 0,0–237,5 | 0,0–5,0 | 0,0–37,5 | ||
| S. hominis | ||||||
| Mittelwert ± SD | 238,6 ± 325,5 | 198,8 ± 242,2 |
0,642 Wilcoxon = 59,0 |
232,1 ± 308,9 | 53,6 ± 73,1 |
= 0,019* Wilcoxon = 9,0 |
| Mittlere | 107,5 | 117,5 | 45,0 | 17,5 | ||
| Min-Max | 7,5–1283,7 | 2,5–825,0 | 3,4–952,5 | 0,0 bis 242,5 | ||
*p-Wert signifikant auf Niveau <0,05*, S1: erste Sitzung mit Nd:YAG-Laser, S4: vierte Sitzung mit Nd:YAG-Laser
Es gab eine statistisch signifikante positive Korrelation zwischen Schweißgeruch und der Gesamtzahl aerober Bakterien ( r = 0,433, p = 0,017), der Gesamtzahl anaerober Bakterien ( r = 0,377, p = 0,040), der Gesamtzahl an Staphylokokken ( r = 0,383, p = 0,036) und S. hominis ( p = 0,497, p = 0,005), d. h. je höher die Bakterienzahl, desto höher die Wahrscheinlichkeit für normalen Schweißgeruch und umgekehrt. Lipophile Bakterien und S. saprophyticus korrelierten nicht mit Schweißgeruch [Tabelle 6].
| Bakterielle Parameter | rs | p-Wert |
|---|---|---|
| Aerobier insgesamt | 0,433 | 0,017* |
| Gesamtanzahl Anaerobier | 0,377 | 0,040* |
| Staphylokokken insgesamt | 0,383 | 0,036* |
| Lipophile Bakterien | 0,163 | 0,390 |
| S. saprophyticus | 0,301 | 0,105 |
| S. hominis | 0,497 | 0,005* |
rs: Spearman Rho Korrelationskoeffizient
*: p-Wert signifikant auf Niveau <0,05
Fünf Teilnehmerinnen berichteten von wiederholter Follikulitis in den Achselhöhlen vor den Laserbehandlungen. Alle fünf berichteten von einer Besserung dieses Problems bis zum Ende der Studie. Bei der Beurteilung der Bakterienzahlen bei diesen fünf Teilnehmerinnen stellte sich heraus, dass alle mittleren Bakterienzahlen zurückgegangen waren. Aufgrund der geringen Anzahl konnte jedoch kein Signifikanztest durchgeführt werden.
Diskussion
Es gibt bisher keine Studien, die die Wirkung des Nd:YAG-Lasers auf die Hautflora und Krankheitserreger in vivo untersucht haben. Die Untersuchung der antibakteriellen Wirkung des Nd:YAG-Lasers hat wichtige Implikationen, zum einen aufgrund seiner weit verbreiteten Verwendung zur Haarentfernung. Zum anderen könnte die antibakterielle Wirkung des Nd:YAG-Lasers zur Dekolonisierung der Haut genutzt werden; unseres Wissens nach ist dies ein potenzielles Anwendungsgebiet, das bisher noch nicht vorgeschlagen wurde. Ziel der Hautdekolonisierung ist die Reduzierung der bakteriellen Belastung der Haut präoperativ, um Wundinfektionen vorzubeugen, die bei hoher bakterieller Belastung auftreten. Wichtige an solchen Infektionen beteiligte Krankheitserreger sind S. aureus , insbesondere MRSA. Die Ergebnisse unserer Studie könnten zur Entwicklung neuer Dekolonisierungsstrategien beitragen, insbesondere im Zeitalter der Multiresistenz. Der Grad der Reduzierung der bakteriellen Belastung entweder bei der Zählung vor im Vergleich nach der Sitzung oder bei der Zählung vor S im Vergleich vor S4 war bei den Teilnehmern unterschiedlich (50 %–70 %). Diese Unterschiede zwischen den Teilnehmern können auf persönliche Faktoren wie die Zusammensetzung und Menge der Talgsekrete sowie auf bakterielle Virulenzfaktoren zurückgeführt werden, die stammspezifisch sind und zum erneuten Wachstum von Bakterien beitragen können. Inwieweit eine Bakterienreduzierung bei der Linderung von Schweißgeruch hilfreich sein kann, bedarf weiterer Studien, da die positive Rolle der Hautflora ein angemessenes Gleichgewicht ihrer Anzahl erfordert.
Studien haben von einer Dominanz von Staphylokokken gegenüber anderer aerober Achselflora (aerobe Coryneforme und Mikrokokken) berichtet, insbesondere bei Frauen. 10,11 Da unsere Teilnehmerinnen alle weiblich waren, wurden Staphylokokken für unsere Studie als wichtige mikrobielle Achselflora ausgewählt.
In der vorliegenden Studie betrug die mittlere Gesamtzahl aerober Bakterien zu Beginn 778,3 ± 1429,7 × 105 KBE/ cm2 und ist damit höher als der von Fazel et al. (179,7 × 105 KBE/ cm2 ) berichtete Wert. 12 In der vorliegenden Studie war S. hominis die am häufigsten vorkommende Staphylokokkenart, gefolgt von S. Saprophyticus und S. epidermidis . In Übereinstimmung mit unseren Ergebnissen berichteten Kloos & Musselwhite 13 , dass S. hominis die am häufigsten auf der Achselhaut vorkommende Art war. Fazel et al . 12 berichteten jedoch, dass die vorherrschenden Bakterien zu Beginn S. aureus waren, gefolgt von S. epidermidis und dann S. saprophyticus . Diese Unterschiede könnten auf Unterschiede in den untersuchten Populationen zurückzuführen sein, einschließlich Alter, persönlichen Gewohnheiten und Vorsichtsmaßnahmen vor der Probenentnahme. Auch Unterschiede bei den verwendeten Labormedien und -techniken könnten zu diesen Unterschieden beigetragen haben.
In der vorliegenden Studie zeigte sich beim Vergleich der mittleren Bakterienzahlen vor und nach der Sitzung eine signifikante Verringerung der Koloniezahlen aller Aerobier, Anaerobier, lipophilen Bakterien, Staphylokokken und S. hominis . Dieses Ergebnis war bei allen vier Lasersitzungen gleich, wobei die Koloniezahlen nach der Sitzung deutlich niedriger waren als vor der Sitzung. Bei den Zahlen von S. epidermidis , S. saprophyticus und S. aureus war keine ähnlich signifikante Verringerung zu beobachten. Dies ist wahrscheinlich auf die niedrigeren Koloniezahlen dieser Arten zurückzuführen, die in unserer Studie isoliert wurden. Die sofortige antibakterielle Wirkung des Nd:YAG-Lasers wurde auch in einer In-vitro- Studie an S. aureus und Pseudomonas aeruginosa (nach 24 Stunden) berichtet. 14
In unserer Studie wurde eine verzögerte antibakterielle Wirkung des Nd:YAG-Lasers dokumentiert. Beim Vergleich der vor der ersten und vierten Sitzung entnommenen Proben kam es zu einer Verringerung der Gesamtzahl aerober, anaerober, Staphylokokken- und S. hominis -Bakterien. Es gab auch eine signifikante sofortige, jedoch nicht verzögerte Hemmwirkung des Nd:YAG-Lasers auf die Zahl lipophiler Bakterien. Dies kann auf Schwankungen der bakteriellen Anfälligkeit gegenüber dem Laser sowie auf die Fähigkeit einiger Arten, sich besser zu erholen als andere, zurückzuführen sein. Es wurde festgestellt, dass zwischen den Zahlen der zweiten und dritten Sitzung kein signifikanter Unterschied bestand, während der Unterschied zwischen der ersten und vierten Sitzung signifikant war. Dies weist darauf hin, dass die verzögerte bakterielle Hemmwirkung des Nd:YAG-Lasers mindestens vier Sitzungen benötigt, um signifikant zu werden. Fazel et al . 12 berichteten von einer signifikanten Verringerung der durchschnittlichen Bakterienkolonie im Achselbereich der Laserteilnehmer nach der sechsten Haarentfernungssitzung.
Bei mehr als der Hälfte der Teilnehmer (50 %–96,3 %) und bei allen Lasersitzungen erreichte der Prozentsatz der Reduktion der Bakterienanzahl zwischen jeder Vor- und Nachsitzung ≥50 % (mit Ausnahme der anaeroben Zählung der 2. Sitzung). Die häufigsten Bakterienreduktionsraten wurden bei der Zählung lipophiler Bakterien festgestellt, wo 55,2 %–96,3 % der Teilnehmer bei allen vier Lasersitzungen eine Reduktion der Anzahl vor und nach der Sitzung um ≥50 % aufwiesen (p = 0,003) (Tabelle S1).
Was die verzögerte Hemmwirkung des Lasers (vor S gegenüber vor S4) betrifft, so konnte bei 50–70 % der Teilnehmer eine Verringerung der Keimzahl um mindestens 50 % bei verschiedenen Bakterienparametern festgestellt werden.
Die antibakterielle Wirkung des Nd:YAG-Lasers kann die Linderung wiederholter Follikulitis erklären, von der fünf Teilnehmerinnen der vorliegenden Studie berichteten. Staphylokokken, insbesondere S. aureus , sind die häufigste Ursache bakterieller Follikulitis, während zu den weniger häufig beteiligten Gattungen Streptokokken, Pseudomonas und coliforme Bakterien zählen. 15 Bei der Ermittlung der mittleren Bakterienzahl dieser fünf Teilnehmerinnen waren alle durchgeführten Bakterienzählungen reduziert, aber aufgrund der geringen Zahl konnte kein Signifikanztest durchgeführt werden. Die Verringerung der Staphylokokken (einschließlich S. aureus ) könnte die Besserung der Follikulitis nach Nd:YAG-Lasersitzungen erklären.
Mögliche Erklärungen für die antibakterielle Wirkung des Lasers sind (a) die Unterdrückung des DNA-Stoffwechsels und der Zellteilung, was zu degenerativen Veränderungen bis hin zur Zellpyknose führt. Bakterien reagieren in drei Phasen auf die Laserbestrahlung: Phase 1, Bakterien gehemmt, aber lebensfähig; Phase 2, Bakterien nicht lebensfähig, aber intakt; und Phase 3, physikalische Auflösung der Bakterien, 16 (b) Bestrahlung eines endogenen bakteriellen Photosensibilisators, was zur Induktion reaktiver Sauerstoffspezies führt, 17 (c) Modulation der transmembranären Konvektion direkt durch den Laser, 18 (d) Bei pigmentierten Bakterien führt die Absorption des Laserlichts durch die Pigmente im Inneren der Bakterien zur Verdampfung von Wasser und zur Zelllyse, 19 (e) stimulierende Wirkung auf menschliche Lymphozyten. 20
Zu den Nebenwirkungen der Laser-Haarentfernung zählen Schmerzen, Erythem, Ödem, Dyschromie, Blasenbildung, Erosionen oder Purpura.1 Es wurde über Veränderungen der Schweißproduktion berichtet, diese wurden jedoch nicht gründlich untersucht. In der vorliegenden Studie berichteten die meisten Frauen entweder von keiner Veränderung ihres Schweißgeruchs (53,3 %) oder von einer Verschlechterung des Geruchs (40 %). Nur zwei Frauen (6,7 %) berichteten von einer Verbesserung ihres Geruchs. In der Studie von Fazel et al.12 berichteten die meisten (63,3 %) Teilnehmerinnen, die sich sechs Sitzungen einer Alexandritlaserbehandlung unterzogen, von einer Verbesserung des Schweißgeruchs; 20 % berichteten von einem unveränderten Geruch und 16,7 % von einer Verschlechterung des Geruchs. Die diesbezüglichen Unterschiede zwischen den Studien können auf mehrere Faktoren zurückgeführt werden, darunter Unterschiede bei den Lasergeräten, verschiedene verwendete Laserparameter, die Anzahl der Sitzungen sowie ethnische und individuelle Unterschiede.
Durch Laser verursachte Veränderungen des Schweißgeruchs können auf persönliche Faktoren (wie Schweißmenge und -zusammensetzung, persönliche Hygienegewohnheiten und genetische Faktoren) sowie auf das Zusammenspiel von Bakterienarten durch Antagonismus oder Synergismus zurückzuführen sein. In der vorliegenden Studie wurde eine signifikante Korrelation zwischen verstärktem Schweißgeruch und einer geringeren Gesamtzahl an Aerobiern (Zahlen bereits im Abschnitt „Ergebnisse“), Anaerobiern, Staphylokokken und S. hominis festgestellt. Unsere Ergebnisse widersprechen denen von Troccaz et al ., 21 , die berichteten, dass sich der Schweißgeruch bei geringerer Anzahl an S. hominis -Bakterien in der Achselhöhle und höherer Anzahl an S. epidermidis verbesserte. Im Gegensatz dazu berichteten Rennie et al . 22 von einem fehlenden Zusammenhang zwischen der Gesamtbakterienzahl von Staphylokokken und Achselgeruch, während zwischen coryneformen Bakterien eine statistisch signifikante Verbindung mit der Geruchsintensität bestand. 22 Fazel et al . 12 berichteten, dass S. epidermidis bei denjenigen mit verbessertem Geruch vorherrschte, Micrococcus luteus bei denjenigen mit verschlechtertem Geruch und S. aureus bei denjenigen mit unverändertem Geruch. Im Gegensatz dazu war in unserer Studie S. hominis bei allen Teilnehmern vorherrschend, unabhängig von ihrem Schweißgeruch. Troccaz et al . 21 fanden auch heraus, dass unangenehmer Körpergeruch mit höheren Anteilen von Corynebacterium, Anaerococcus, Peptoniphilus und S. hominis verbunden war, möglicherweise aufgrund ihrer Produktion von übelriechenden flüchtigen Stoffen aus apokrinem Schweiß. Obwohl in der vorliegenden Studie im Gegensatz zu den meisten anderen Studien eine höhere Anzahl von Aerobiern, Anaerobiern und Staphylokokken mit besserem Schweißgeruch in Verbindung gebracht wurde, ist es möglich, dass andere, nicht getestete Bakterienarten gleichzeitig abgenommen haben, was zu einem verbesserten Schweißgeruch bei unseren Probanden beigetragen hat. Der Zusammenhang zwischen bestimmten Arten und verbessertem Geruch wurde in einigen Studien als Therapieoption gegen schlechten Geruch untersucht. Dabei wurde eine bakterielle Achseltransplantation durchgeführt, bei der das übelriechende Mikrobiom durch ein gesundes, geruchsfreies Achselmikrobiom ersetzt wird. 23 Die Transplantation des Achselmikrobioms wurde nur in wenigen Studien als klinische Versuche zur Verbesserung des Achselgeruchs durchgeführt. Unseres Wissens wurden in diesen Studien keine Nebenwirkungen nach der Mikrobiomtransplantation berichtet, unabhängig davon, ob diese Bakterien von derselben Person, aber von einer anderen Körperstelle (homolog) oder von der Achselhaut einer anderen Person transplantiert wurden. Weitere Studien in der Zukunft könnten uns mehr Beweise für die Sicherheit dieser Transplantation und das Auftreten möglicher Nebenwirkungen liefern, zu denen Überempfindlichkeit oder möglicherweise ein allmähliches Verschwinden des transplantierten Mikrobioms und seine Ersetzung durch das primäre, unerwünschte Mikrobiom gehören könnten.
Bei Frauen, die unveränderten Schweißgeruch berichteten, zeigten sich keine signifikanten Unterschiede in den mittleren Bakterienzahlen vor und nach der Laserbehandlung. Allerdings kann der Laser eine speziesabhängige Wirkung haben, die zu Dysbiose führt, wobei einige Spezies im Vergleich zu anderen zunehmen, wie Troccaz et al . 21 und Fazel et al . 12 berichten. In unserer Studie konnte jedoch keine Dysbiose in Bezug auf andere Spezies nachgewiesen werden, da nur Staphylokokken untersucht wurden.
In unserer Studie berichteten 53,3 % der Frauen von keiner Veränderung ihrer Schweißmenge, 33,3 % von einer erhöhten Menge und 13,4 % von verringertem Schwitzen. Aydin et al . untersuchten eine erhöhte Achselschweißproduktion durch einen 1064 nm Nd:YAG-Laser. 24 nach 6–10 Sitzungen zur Laser-Haarentfernung im Monat (10 mm Punktgröße, 30–60 J/cm Fluenz und 55–65 ms Pulsbreite). Dies steht im Einklang mit einigen Berichten über die Induktion einer sympathischen Hautreaktion nach Laserstimulation 25,26 Andererseits wirkt die Verringerung der Achselschweißproduktion durch 1064 nm Nd:YAG zur Behandlung von Bromidrose subdermal und nicht transdermal. Der Laser erreicht sein Ziel direkt, was zu histopathologischen Veränderungen in den ekkrinen Drüsen mit einer wirksamen Verringerung der hyperhidrotischen Aktivität führt. Sie legen auch nahe, dass die Erwärmung die umgebenden Nervenfasern beeinflusst und so zum klinischen Effekt beiträgt. 27 Neben unseren Ergebnissen wurden ähnliche Befunde bei der Achselhaarentfernung mit Dioden- und Alexandritlasern und sogar bei inguinaler Hyperhidrose nach inguinaler Laser-Haarentfernung berichtet. 28–30 Aus früheren Daten kann man spekulieren, dass ein 1064 nm Nd:YAG-Laser bei transdermaler Anwendung sowohl eine stimulierende Wirkung auf die Achselschweißbildung als auch bei subdermaler Anwendung eine hemmende Wirkung haben könnte. Laut Helou et al . waren für das Einsetzen einer Hyperhidrose im Durchschnitt 6 Lasersitzungen erforderlich, wobei mindestens 3 und höchstens 11 Sitzungen erforderlich waren. 29
Der zugrunde liegende Mechanismus für übermäßiges Schwitzen nach der Laserbehandlung ist noch nicht vollständig verstanden. Der Laser kann direkte thermische Verletzungen oder eine indirekte Stimulation über Nervenfasern an Schweißdrüsen in der Nähe der Haarfollikel verursachen. Geräte, die im nahen Infrarot-Wellenlängenbereich arbeiten, dringen tief in die Dermis und sogar in das subkutane Gewebe ein und zielen auf die stark pigmentierte Matrix des Haares ab. Daher könnte die tief eindringende Energie die Schweißdrüsen aktivieren, die in der Nähe der tiefen Haarzwiebeln der Achselhöhle liegen, wenn der Laser durch die Hautoberfläche angewendet wird. Dieser hyperaktive Zustand ist in 76,7 % der Fälle vorübergehend. 29 Dies ist durch den Einfluss der periglandulären Temperatur auf den Drüsenstoffwechsel, die Freisetzung und den Stoffwechsel von Neurotransmittern, den Membrantransport und die Rezeptoraffinität möglich. 30
Im Gegenteil, Letada et al . 31 berichteten von einer signifikanten Verringerung der Achselschweißbildung nach fünf Sitzungen mit einem 1064 nm Nd:YAG-Laser. Die histologische Analyse des Achselgewebes zeigte keine nennenswerten Veränderungen zwischen vor und nach der Behandlung. Dies führte Letada et al . 31 zu dem Schluss, dass der Wirkungsmechanismus zelluläre oder subzelluläre Veränderungen durch die Erwärmung von Melanin- oder Wasserchromophoren beinhalten könnte, was sich auf die sympathischen cholinergen Übertragungen in der Achsel auswirkt. 32
Zu den Einschränkungen der vorliegenden Studie gehörten eine kleine Stichprobengröße, wenige Lasersitzungen, ein kurzer Nachbeobachtungszeitraum und eine subjektive Beurteilung von Schweißgeruch und -menge; in die Studie wurden nur begrenzte Bakterienarten einbezogen. Das Fehlen einer Kontrollgruppe, ausschließlich weibliche Studienteilnehmer und die Einbeziehung nur der Achselhöhle sind weitere Einschränkungen.
Abschluss
Nd:YAG-Laser (1064 nm) können eine antibakterielle Wirkung gegen bestimmte Bakterienarten haben. Es wurden sowohl sofortige als auch verzögerte antibakterielle Wirkungen beobachtet, aber um die Dauer dieser Wirkungen beurteilen zu können, sind längere Nachuntersuchungen erforderlich. Nd:YAG-Laser können auch den Schweißgeruch beeinflussen, indem sie das lokale Mikrobiom der Haut verändern.
Einverständniserklärung des Patienten
Die Autoren bestätigen, dass sie alle erforderlichen Einwilligungen der Patienten eingeholt haben.
Finanzielle Unterstützung und Sponsoring
Null.
Interessenkonflikte
Es bestehen keine Interessenkonflikte.
Ergänzende Datei 1 herunterladenVerweise
- Tanzi EL, Alster TS. Langgepulste 1064-nm-Nd:YAG-Laser-unterstützte Haarentfernung bei allen Hauttypen. Dermatol Surg . 2004;30:13-7.
- [CrossRef] [PubMed] [Google Scholar]
- Kang CN, Shah M, Lynde C, Fleming P. Haarentfernungspraktiken: Eine Literaturübersicht. Skin Therapy Lett . 2021;26:6-11.
- [Google Scholar]
- Lask G, Elman M, Slatkine M, Waldman A, Rozenberg Z. Laserunterstützte Haarentfernung durch selektive Photothermolyse. Vorläufige Ergebnisse. Dermatol Surg . 1997;23:737-9.
- [CrossRef] [PubMed] [Google Scholar]
- Lin TY, Manuskiatti W, Dierickx CC, Farinelli WA, Fisher ME, Flotte T, et al. Haarwachstumszyklus beeinflusst die Zerstörung der Haarfollikel durch Rubinlaserpulse. J Invest Dermatol . 1998;111:107-13.
- [CrossRef] [PubMed] [Google Scholar]
- Russ D, Kienle A, Falkenstein W, Steiner R. Optimierung der Laserepilation durch Simulation der thermischen Wirkung der Laserstrahlung. Laser-Medizin: eine interdisziplinäre Zeitschrift; Praxis, Klinik, Forschung . 2000;15:87-95.
- [PubMed] [Google Scholar]
- James AG, Austin CJ, Cox DS, Taylor D, Calvert R. Mikrobiologische und biochemische Ursprünge des menschlichen Achselgeruchs. FEMS Microbiol Ecol . 2013;83:527-40.
- [CrossRef] [PubMed] [Google Scholar]
- Herbenick D, Hensel D, Smith NK, Schick V, Reece M, Sanders SA, et al. Schamhaarentfernung und Sexualverhalten: Ergebnisse einer prospektiven Tagebuchstudie über sexuell aktive Frauen in den USA. J Sex Med . 2013;10:678-85.
- [CrossRef] [PubMed] [Google Scholar]
- Selwyn S, Ellis H. Hautbakterien und Hautdesinfektion neu betrachtet. Br Med J . 1972;1:136-40.
- [CrossRef] [PubMed] [Google Scholar]
- Condalab. Chromogener Staphylococcus-Agar. Verfügbar unter: https://www.condalab.com/int/en/culture-media-for-clinical-diagnosis/1311-14886-staphylococcus-chromogenic-agar.html. [Zugriff im: August 2022].
- Callewaert C, Kerckhof FM, Granitsiotis MS, Van Gele M, Van de Wiele T, Boon N. Charakterisierung von Staphylokokken- und Corynebakterienclustern in der menschlichen Achselregion. PLoS One . 2013;8:e70538.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
- Taylor D, Daulby A, Grimshaw S, James G, Mercer J, Vaziri S. Charakterisierung der Mikroflora der menschlichen Achselhöhle. Int J Cosmet Sci . 2003;25:137-45.
- [CrossRef] [PubMed] [Google Scholar]
- Fazel Z, Majidpour A, Behrangi E, Fathizadeh S, Nokandeh M, Atefi N, et al. Verwendung des Haarentfernungslasers im Achselbereich und seine Wirkung auf die normale mikrobielle Flora. J Lasers Med Sci . 2020;11:255-61.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
- Kloos WE, Musselwhite MS. Verbreitung und Persistenz von Staphylococcus- und Micrococcus-Arten und anderen aeroben Bakterien auf der menschlichen Haut. Appl Microbiol . 1975;30:381-5.
- [CrossRef] [PubMed] [Google Scholar]
- Ebid AA, Alhammad RM, Alhindi RT, Alghamdi AA, Alqarhi AK, Abdullah HA, et al. Wirkung eines Hochleistungs-Nd:YAG-Lasers auf das Wachstum von Staphylococcus aureus und Pseudomonas aeruginosa: Eine experimentelle Studie. J Phys Ther Sci . 2021;33:222-8.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
- Luelmo-Aguilar J, Santandreu MS. Follikulitis: Erkennung und Behandlung. Bin J Clin Dermatol . 2004;5:301-10.
- [CrossRef] [PubMed] [Google Scholar]
- Yuan X, Song Y, Song Y, Xu J, Wu Y, Glidle A, et al. Wirkung von Laserbestrahlung auf die Zellfunktion und ihre Auswirkungen in der Raman-Spektroskopie. Appl Environ Microbiol . 2018;84:e02508-17.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
- Seyedmousavi S, Hashemi SJ, Rezaie S, Fateh M, Djavid GE, Zibafar E, et al. Auswirkungen von schwacher Laserbestrahlung auf die Pathogenität von Candida albicans: In-vitro- und In-vivo-Studie. Photomed Laser Surg . 2014;32: 322-9.
- [CrossRef] [PubMed] [Google Scholar]
- Sommer AP, Zhu D, Scharnweber T. Lasermodulierte transmembranäre Konvektion: Einsatz in der Krebschemotherapie. J Control Release . 2010;148:131-4.
- [CrossRef] [PubMed] [Google Scholar]
- Gokhale S, Padhye A, Sumanth S. Bakterizide Wirkung des Nd:YAG-Lasers in einem In-vitro -Gewebemodell – eine lichtmikroskopische Untersuchung. J Oral Laser Appl . 2010;10:17.
- [Google Scholar]
- Bjordal JM, Johnson MI, Iversen V, Aimbire F, Lopes-Martins RA. Low-Level-Lasertherapie bei akuten Schmerzen: eine systematische Überprüfung möglicher Wirkmechanismen und klinischer Effekte in randomisierten, placebokontrollierten Studien. Photomed Laser Surg . 2006;24:158-68.
- [CrossRef] [PubMed] [Google Scholar]
- Troccaz M, Gaïa N, Beccucci S, Schrenzel J, Cayeux I, Starkenmann C, et al. Kartierung der für Körpergerüche verantwortlichen Achselmikrobiota mit einem kulturunabhängigen Ansatz. Mikrobiom . 2015;3:3.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
- Rennie PJ, Gower DB, Holland KT, Mallet AI, Watkins WJ. Die Hautmikroflora und die Bildung menschlichen Achselgeruchs. Int J Cosmet Sci . 1990;12:197-207.
- [CrossRef] [PubMed] [Google Scholar]
- Callewaert C, Lambert J, Van de Wiele T. Auf dem Weg zu einer bakteriellen Behandlung von Achselgeruch. Exp Dermatol . 2017;26:388-91.
- [CrossRef] [PubMed] [Google Scholar]
- Aydin F, Pancar GS, Senturk N, Bek Y, Yuksel EP, Canturk T, et al. Achselhaarentfernung mit 1064 nm Nd:YAG-Laser steigert die Schweißproduktion. Clin Exp Dermatol . 2010;35:588-92.
- [CrossRef] [PubMed] [Google Scholar]
- Cervera A, Veciana M, Valls-Solé J. Sympathische sudomotorische Hautreaktionen durch Laserreize bei normalen menschlichen Probanden. Neurosci Lett . 2002;334:115-8.
- [CrossRef] [PubMed] [Google Scholar]
- Rossi P, Truini A, Serrao M, Iannetti GD, Parisi L, Pozzessere G, et al. Sympathische Hautreaktion hervorgerufen durch Laser-Hautstimulation. Funct Neurol . 2002;17:129-32.
- [PubMed] [Google Scholar]
- Goldman A, Wollina U. Subdermaler Nd:YAG-Laser für axilläre Hyperhidrose. Dermatol Surg . 2008;34:756-62.
- [CrossRef] [PubMed] [Google Scholar]
- Hélou J, Soutou B, Jamous R, Tomb R. Nouveaux effets indésirables du laser dépilatoire axillaire [Neuartige Nebenwirkungen der lasergestützten Achselhaarentfernung] Annales de Dermatologie et de Vénéréologie . 2009;136:495-500.
- [PubMed] [Google Scholar]
- Helou J, Habre M, Soutou B, Maatouk I, Ibrahim T, Tomb R. Reversibilität der Hyperhidrose nach Achselhaarentfernung mit Laser. Lasers Med Sci . 2014;29:717-21.
- [CrossRef] [PubMed] [Google Scholar]
- Obeid G, Helou J, Maatouk I, Moutran R, Tomb R. Enthaarungslaser: ein möglicher ursächlicher Faktor für inguinale Hyperhidrose: Bericht über drei Fälle. J Cosmet Laser Ther . 2013;15:286-9.
- [CrossRef] [PubMed] [Google Scholar]
- Letada PR, Landers JT, Uebelhoer NS, Shumaker PR. Behandlung von fokaler axillärer Hyperhidrose mit einem langgepulsten Nd:YAG 1064 nm-Laser bei Haarentfernung. J Drugs Dermatol . 2012;11:59-63.
- [PubMed] [Google Scholar]
- Cervantes J, Perper M, Eber AE, Fertig RM, Tsatalis JP, Nouri K. Laserbehandlung der primären axillären Hyperhidrose: Eine Literaturübersicht. Lasers Med Sci . 2018;33:675-81.
- [CrossRef] [PubMed] [PubMed Central] [Google Scholar]
-
Abschnitte -
Statistiken -
Herunterladen
- Einführung
- Themen und Methoden
- Lasersitzungen
- Probenentnahme
- Labormethoden
- Statistische Analyse
- Ergebnisse
- Die sofortige antimikrobielle Wirkung des Nd:YAG-Lasers
- Die verzögerte antimikrobielle Wirkung des Nd:YAG-Lasers
- Subjektive Veränderungen des Schweißgeruchs und der Schweißmenge
- Diskussion
- Abschluss
Empfohlene Lektüre für verwandte Artikel:
- 26. April 2023
- 21. Februar 2024
- 23. August 2024






































